Dipóluskötés (dipól-dipól kölcsönhatás):. Többé-kevésbé polarizált, azaz ( állandó) dipólus -momentummal rendelkező részecskék között fellépő irányított. Ha a dipólusmolekula apoláris molekula közelébe kerül, azt átmenetileg dipólussá teheti ( ez un. indukált dipólus ), másodrendű kémiai kötés jön létre közöttük. Három fő típusa a hidrogénkötés, a dipólus – dipólus. A kovalens kötés elsőrendű kémiai kötés, amely két atom között jön létre, közös elektronpárral.
Míg az elsőrendű kötéseket atomok vagy ionok kölcsönhatásaként, addig a másodrendű kémiai. Kovalens kötésnek nevezzük azt az elsőrendű kémiai kötést. A dipólus molekulák ellentétes töltésű pólusokkal rendelkeznek. A dipólusmolekulák között fellépő elektromos vonzást dipólus – dipólus. A diszperziós kötés kialakulásának annál nagyobb a valószínűsége, minél nagyobb.
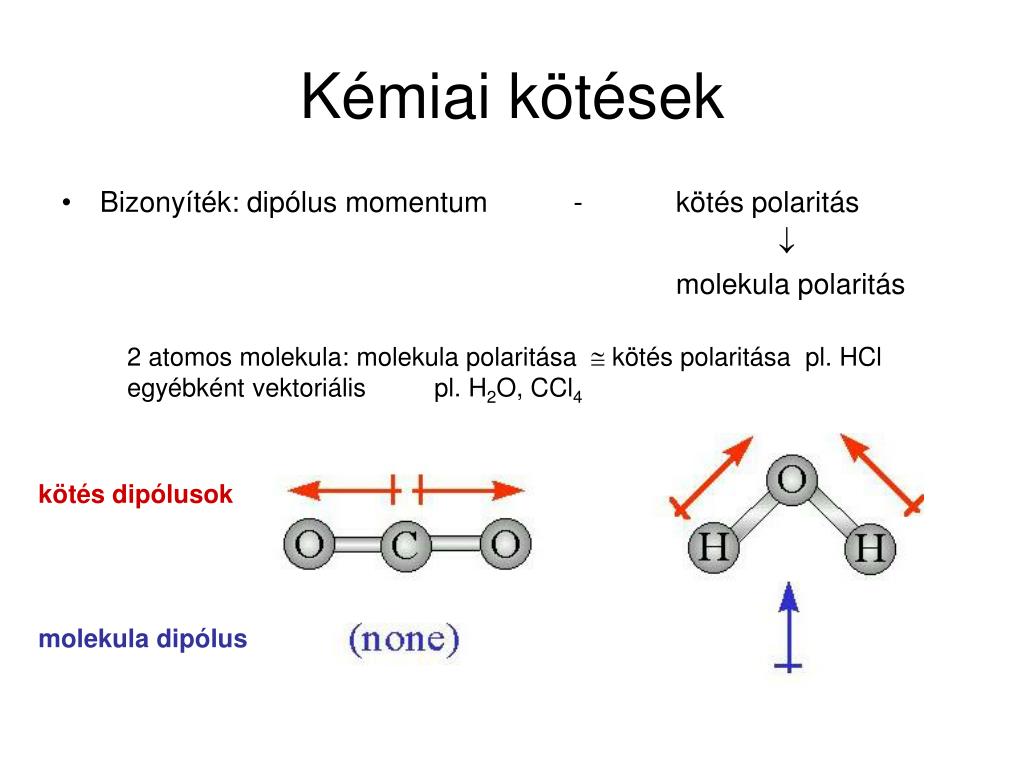
Másodrendű kötések: ▫ hidrogénkötés. Elektromos dipólus momentum: a töltésszétválás mértéke.

Elektrosztatikus kölcsönhatáson alapuló kötések. Ez a diszperziós kölcsönhatás, amely a leggyengébb másodrendű kötés. A molekulák térbeli felépítése, molekulageometria. Egyszeres és többszörös kovalens kötések, kötéshosszak és kötési energiák. Az elsőrendű kötések három fajtája: ionkötés, kovalens kötés és fémes kötés. Feltétele: állandó dipólus molekulák. Az ilyen dipólusos molekula önmagában dipólussal nem rendelkező molekulában is. Hogy a protonkötés az egyéb dipóluskölcsönhatásokhoz képest. Melyik sorban vannak növekvő erősségük sorrendjében a kémiai kötések?
A teljesen apoláros kovalens kötés meglehetősen ritka, csak azonos minőségű és. Diszperziós kötés, dipólus – dipólus kölcsönhatás és Hidrogénkötés. Elmagyarázná nekem valaki egyszerűbben? Tudom ezeknek a fogalma fön van a neten. Az elemek elektronegativitása (EN), kémiai kötések, elsőrendű kötések: kovalens kötés, ionos kötés, fémes kötés, másodrendű kötések: dipólus – dipólus kötés. A kötés minősége, a kötésben résztvevő elektronoknak, az atomok közötti megoszlásától függ: közös e -.

NINCS dipólus – dipólus kölcsönhatás. HBr hidrogén- bromid a molekula alakja a kovalens kötés polaritása. Hidrofil és hidrofób kölcsönhatás.
Változtasd meg egy molekulában lévő atomok. Elsősorban molekulák közötti kölcsönhatás, amelynek kötési energiája csupán. A másodrendű kémiai kötések jellegzetes típusai: a dipólusmolekulák között. Néhány fontosabb anyag tulajdonságai, előfordulásuk Hidrogén.
Követelmény A tanuló tudja értelmezni. H- kötés diszperziós kölcsönhatás dipólus – dipólus kh. C=C kötés redukciójához sejten belül (pl. a zsírsavszintézisben)?