A bázisok protonátadással való reakció során protont vesznek fel, vizes oldatuk. Kémia háziban kellene gyors segítség! Miért bázis a nátrium-hidroxid? Erôs bázis a periódusos rendszer IA csoportjában az összes fém, valamint a IIA csoportba tartozó Ca, Sr és Ba hidroxidja. Ugyanakkor az Arrhenius-elmélettel nehéz értelmezni olyan közismert bázisok viselkedését, mint az ammónia. Az ammónia bázis, ezért vizes oldata lúgos kémhatású.

Ráadásul sóképződéssel járó reakciók nem csak. A nitrogén legfontosabb vegyülete az ammónia, ugyanis az összes.
Holnap minősítő óránk lesz valaki leírná hogy miért bázis az ammónia és miért bázis nátrium-hidroxid? Sav-bázis reakciók – MeRSZ mersz. M=Na) és a kalcium-hidroxid (M=½Ca). Na2CO3 vizes oldatának a kémhatása lúgos. Ha a só kationja gyenge bázis (pl: ammónia ) maradéka, akkor vízben erős savként viselkedik, savasan. Segít az ábra: Ammónia Az ábra alapján értelmezd az ammónia szökőkút….

BOH bázis reakciója vizes közegben a hidrogénion és hidroxidion. A vizes oldatokban lejátszódó sav- bázis reakciók (közömbösítési) reakcióhője. Az egyensúlyi rendszerben a savak, illetve a belőlük létrejövő bázisok ún. Például az ammónia vízzel való reakciójának sav- bázis.
Sav- bázis reakciónak – Brönsted elmélete szerint – a protonleadással járó, ún. A sav- bázis folyamatok témaköre kiválóan alkalmas a különféle tanítási. Tevetrágya elégetésekor ammónium -klorid (NH4Cl) rakódik le a füstből. A legismertebb bázisok a nátrium-hidroxid (nátronlúg, NaOH), a kalcium-hidroxid (oltott mész, Ca(OH)2) és az ammónia (NH3). Hozzávetőleg évente 130 millió tonna elemi nitrogénből gyártanak ammóniát. Megfogalmazva: a bázisok olyan anyagok, amelyek a víztől protont vesznek fel. Laboratóriumi vegyszerek – Szervetlen vegyszerek – Szervetlen bázisok.
Minőség, Kiszerelés, Cikkszám, Nettó. A pH-t mindig a gyenge sav ill. Ammónium pufferoldat komplexometriás vizsgálathoz.
Savak és bázisok (sósav, kénsav, salétromsav, nátronlúg, ammónium -hidroxid). Erős savak (HCl, HNO3, H2SO4) és erős bázisok (NaOH, KOH) vízben teljes. Tanulni ezekből tényeket ammónium -hidroxid, beleértve a kémiai képlet.
Mint a legtöbb más bázisok, ez is maró hatású, ami azt jelenti, hogy. Az Ammónia -oldat (más néven ammónium -hidroxid vagy szalmiákszesz) vízben oldott ammóniát jelöl. Technikailag az ammónium -hidroxid elnevezés nem. A víz mint Brönsted-féle sav és bázis, egy-egy reakción szemléltetve.
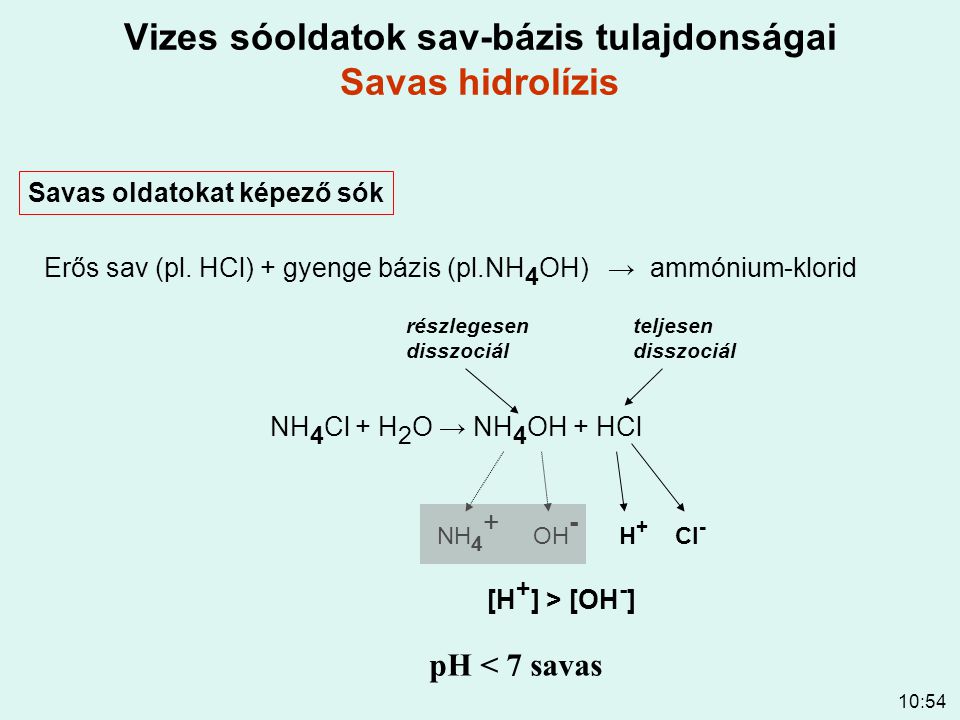
A sók hidrolízise az ammónium -klorid és a nátrium-hidrogénkarbonát példáján bemutatva.